ミトコンドリアの活性化をターゲットにした筋萎縮性側索硬化症(ALS)の治療:
ニコチンアミド・リボシドとジクロロ酢酸はALSの進行を抑制する
ALSは進行の早い致死的な病気です。進行を抑える方法を実践するしかありません。
ALSの発症にはミトコンドリアの機能異常が関与しています。
ニコチンアミド・リボシドやジクロロ酢酸などを併用してミトコンドリアを活性化するとALSの進行抑制に有効です。
■
【ミトコンドリアは元は細菌だった】
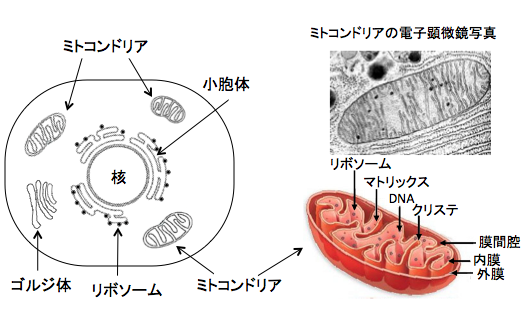
ミトコンドリアは赤血球以外の全ての細胞に存在する細胞小器官です。1個の細胞当たり平均で300~400個のミトコンドリアが存在します。
肝臓や腎臓や筋肉や脳など代謝が活発な細胞には数千個のミトコンドリアが存在し、細胞質の40%程度を占めています。全部で体重の約10%を占めると言われています。
真核細胞のミトコンドリアは好気性細菌のαプロテオバクテリアが原始真核細胞に寄生したものという「細胞内共生説」が定説になっています。
まだ酸素が無い太古の地球に生きていた生物は解糖系のみでエネルギーを得ていました。ところが、海中に発生した藻類が光合成によって吐き出す酸素が大気中に増えていくと、酸素の無い環境で生きていた生物は酸化力の強い酸素に触れることでダメージを受けるようになります。
そのためこの時期には原始真核生物の多くが絶滅し、あるいは酸素の影響を受けることのない深海などに移動していきました。
このような状況で誕生したのが、酸素を使ってATPを生成する好気性細菌です。 そして、約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。
大気中に増える酸素による悪影響に苦しんでいた嫌気性の原始真核生物にとって、酸素を使ってATPを作り出す好気性細菌との共生は好都合でした。 好気性細菌は生体にダメージを与える酸素をグルコースに結合させ、二酸化炭素と水に分解し、さらにその過程でATPを大量に生成することができるからです。この細胞内共生によって酸素が豊富な環境で生物が急速に進化することになります。このように、ミトコンドリアはかつて細菌であったため、見かけは細菌に似ています。直径は1ミクロン(1ミクロンは1000分の1ミリ)以下で、長さは1~4ミクロン程度で、俵型やいも虫様の立体構造をしています。
ミトコンドリアは2枚の膜(内膜と外膜)によって細胞質から隔てられ、内膜は複雑に入り組んで「クリステ」という無数の襞や管を形成しています。内膜が襞上にくびれているのは、表面積を増やすためで、この内膜でATPの産生が行われています。 内膜上に電子伝達系やATP合成にかかわる酵素群などが一定の配置で並んでいます。
マトリックスには、TCA回路に関わる酵素やミトコンドリア独自のDNAなどが含まれています。たんぱく質合成のためにリボソームも持っていてミトコンドリア内でたんぱく合成もできます。そして、ミトコンドリア自身が増殖もします。(下図)
図:細胞内には機能を分担するために、様々な小器官が存在する。ミトコンドリアは酸素を使ってグルコースや脂肪酸やアミノ酸を燃焼してATPを産生する働きや、物質代謝やアポトーシスの制御など多彩は機能を持っている。
【ミトコンドリアは細胞の生存と死の両方を制御している】
ミトコンドリアは酸素を使ってグルコース(ブドウ糖)や脂肪酸やアミノ酸を燃焼してエネルギーのATP(アデノシン3リン酸)を産生する働きがあります。つまり、細胞の発電所のような器官です。
ミトコンドリアはATPの産生以外に、カルシウム代謝の制御、様々な物質の合成、アポトーシス(細胞死)の制御など重要な細胞機能を担っています。
アポトーシスは、形態学上は核の凝集と細胞収縮、それにDNAの断片化などによって特徴づけられる細胞死の一種です。個体の発生段階で、過剰にできた細胞を選択的に除去し、器官形成を完成するのに必要なプロセスです。 また、老化した細胞や修復不能なダメージを受けた細胞を除去する際にも、アポトーシスのメカニズムで細胞死が起こります。 このアポトーシスの過程は極めて複雑ですが、ミトコンドリアに存在するたんぱく質が重要な役割を果たしています。 たとえば、電子伝達系で働く「チトクロームC」というたんぱく質は、ミトコンドリアから放出されると、たんぱく分解酵素群が次々に活性化されて、細胞死へと導きます。 アポトーシスは多数のタンパク質によって制御されていますが、中心になるのがBcl-2やBaxと呼ばれるタンパク質群(Bcl-2ファミリー蛋白質)です。 Bcl-2 ファミリー蛋白質には、アポトーシスを抑制するBcl-2-サブファミリー(Bcl-2, Bcl-XLなど)と、アポトーシスを促進する Baxサブファミリー(Bax、Bakなど) および BH3-onlyサブファミリー (Bid、Bim、Badなど)があります Bcl-2およびそのファミリー蛋白質の主な作用部位はミトコンドリア膜で、このミトコンドリア膜の透過性を制御することにより、細胞の生死を決定しています。 ミトコンドリアの膜透過性が亢進すると、膜間スペースに存在するアポトーシス誘導蛋白質(シトクロムCなど)が細胞質に漏出します。漏出したシトクロムCはカスパーゼと呼ばれる蛋白分解酵素群を段階的に活性化してアポトーシスが実行されます。 Baxはアポトーシス実行時のミトコンドリアの膜透過性亢進に必須の分子として働き、 Bcl-2はBaxと直接結合してBaxの働きを阻止します。 Bcl-2のようなアポトーシス促進蛋白質の活性が、Baxのような抑制蛋白質の活性を凌駕した場合に、ミトコンドリア膜透過性亢進が誘導され、アポトーシスが実行されます。
このように、ミトコンドリアは細胞の生存と死の両方の制御に重要な働きを担っています。
【ミトコンドリアは増やすことができる】
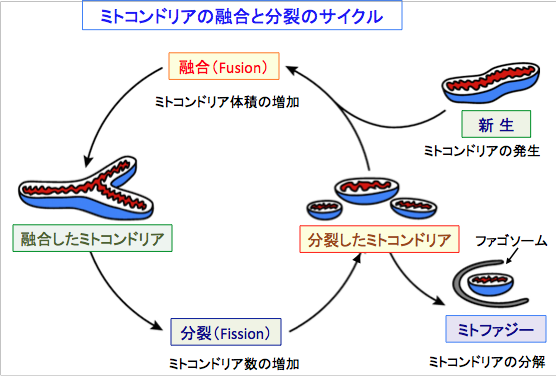
ミトコンドリアは常に融合(fusion)過程により結合し、分裂(fission)過程により分割しています。融合が活性化すると長くつながった構造が形成され、逆に分裂が活性化すると小さな断片化した形状が増えます。このようにミトコンドリアの形態はダイナミックに変化しています。
ミトコンドリア(mitochondria)はギリシャ語の「糸」を意味する「mitos」と「小さい粒」を意味する「chondrion」をつなげた用語です。線状になったり球状になったりする状態を観察して「mitochondria」と命名されたようです。 顆粒状・桿状・糸状のいずれの形のミトコンドリアも、他のミトコンドリアと融合して1本になったり、分裂して数個のミトコンドリアになるというミトコンドリア・ダイナミクスの存在は100年以上前から知られています 。細胞内でミトコンドリアが新しく生じることをミトコンドリア新生 (Mitochondrial biogenesis)と言います。
ミトコンドリアを構成するタンパク質には、核内DNA にコードされているものと、ミトコンドリア内 DNAにコードされているものがあります。核内DNA にコードされているタンパク質は、細胞質で合成された後、ミトコンドリア外膜と内膜を通過してミトコンドリア内部に輸送されます。ミトコンドリアDNAにコードされているたんぱく質はごく少数です。
ダメージを受けて機能異常を起こしたミトコンドリアはミトコンドリアに特異的なオートファジーによる除去システムのミトファジー(mitophagy)によって分解され、新しいミトコンドリアがミトコンドリア新生(mitochondrial biogenesis)によって作られます。 このようなミトファジーとミトコンドリア新生のバランスによってミトコンドリアの品質が決まります。これは、ミトコンドリアの品質を良くすることも可能であることを意味します。
図:細胞内のミトコンドリアの数や体積や形態や機能は、ミトコンドリアの新生(発生)、融合、分裂、分解(ミトファジー)のバランスで制御されている。融合が進行すると大きな管状のネットワークを形成し、分裂が進むと小さなミトコンドリアが増える。ミトコンドリアの融合と分裂のバランスの異常が、様々な疾患の原因となっている。
【神経変性疾患の治療法としてのミトコンドリア品質管理】
筋萎縮性側索硬化症(ASL)では、運動ニューロンのミトコンドリアにダメージが蓄積して運動ニューロンの細胞死が起こることが指摘されています。ミトコンドリアの数を増やし機能を高める方法は、ALSなど神経変性疾患など様々な疾患の治療法として注目されています。ミトコンドリアの品質の向上が筋萎縮性側索硬化症の進行抑制に有効である可能性が指摘されています。
以下のような報告があります。
【要旨】
筋萎縮性側索硬化症(ALS)は、上位および下位の運動ニューロンの喪失を特徴とする壊滅的な神経変性疾患である。 ALSの病因の中心的な決定要因であると提案されているミトコンドリア機能障害を含む、さまざまなメカニズムが疾患の開始と進行に寄与している。
ミトコンドリア機能の欠陥は主にALS発症に関連したSOD1変異体で説明されているが、他のALS症例においてもミトコンドリアの機能不全が関与していることは今では十分に確立されている。
そのような状況において、ミトコンドリア品質管理システムは、ミトコンドリアの正常な機能を回復させ、損傷したミトコンドリアの構成要素を排除および交換することにより、またはミトファジーを通じてオルガネラ全体を分解することにより、細胞死を防ぐことができる。 最近の証拠は、ALS関連遺伝子がミトコンドリアの品質管理システムを妨害することを示している。ミトコンドリアの品質管理は、ミトコンドリアの完全性を維持し、正常なミトコンドリア機能を確保する上で重要な役割を果たしています。したがって、ミトコンドリアの品質管理の欠陥は神経変性疾患の重要な原因となります。
ミトコンドリアの品質管理という方法論でミトコンドリアの機能を良くすれば、ALSなどの神経変性疾患の治療に役立つ可能性があります。
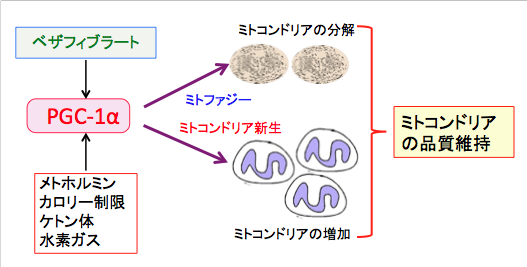
図:PPARの汎アゴニストのベザフィブラートやAMP活性化プロテインキナーゼやサーチュイン1を活性化するメトホルミン、カロリー制限、ケトン体、水素ガスはPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)を活性化する。PGC-1αはミトコンドリア新生を亢進して新しいミトコンドリアを増やし、ミトファジーを亢進して異常なミトコンドリアの分解を亢進する。その結果、ミトコンドリアの品質を良好に維持する。
【サーチュイン1はPGC-1αを活性化してミトコンドリアを増やす】
Mitochondrial Biogenesisは「ミトコンドリア新生」や「ミトコンドリア発生」と訳されています。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PGC-1αは転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。 PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターです。骨格筋、心筋、脂肪、脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られています。
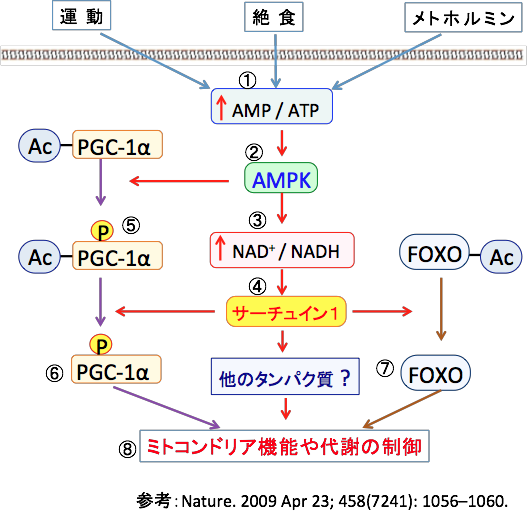
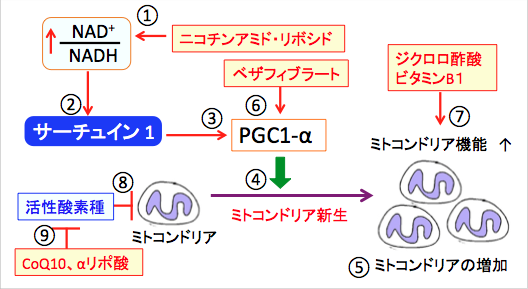
運動すると骨格筋のPGC-1α量が増えます。 運動や絶食やメトホルミンがAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKはサーチュインを活性化して転写因子のPGC-1αとFOXOファミリータンパク質を活性化し、ミトコンドリア機能や代謝を制御することが知られています(下図)。
図:運動や絶食やメトホルミンは筋肉細胞内のAMP/ATP比を上昇し(①)、AMP依存性プロテインキナーゼ(AMPK)を活性化する(②)。AMPK活性化はNAD+/NADH比を高め(③)、サーチュイン1(SIRT1)を活性化する(④)。AMPKはPGC-1α(Peroxisome Proliferator- activated receptor gamma coactivator-1α:ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)をリン酸化し(⑤)、さらにSIRT1で脱アセチル化されて活性化する(⑥)。サーチュイン1はFOXOファミリーなどの転写因子を脱アセチル化して活性化する(⑦)。活性化したPGC-1αやFOXOはミトコンドリア機能や代謝を制御する。(図中のPはリン酸化、Acはアセチル基を示す)
【ニコチンアミド・リボシドはNAD+を増やしてALSの進行を抑制する】
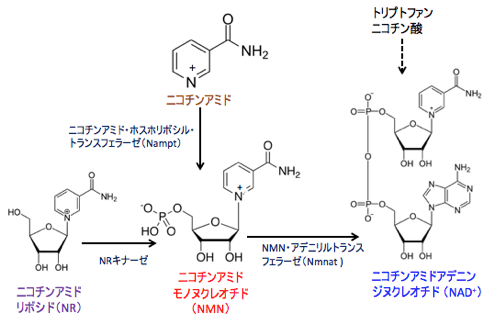
NAD+(ニコチンアミドアデニンジヌクレオチド)はナイアシンというビタミンから体内で合成されます。NAD+は解糖系およびミトコンドリアでのエネルギー産生反応に必要な因子です。
NAD+レベルは加齢とともに低下し、加齢に関連する疾患の発症に重要な役割を担っていることが明らかになっています。
NAD+の細胞内レベルを上昇させる方法は、動物モデルで老化を遅らせ、筋肉機能を回復させ、脳での神経再生を促進し、代謝性疾患を改善することが示されています。
筋萎縮性側索硬化症(ALS)の治療にもNAD+の細胞内レベルを上昇させる方法の有効性が指摘されています。 以下のような報告があります。
【要旨】
筋萎縮性側索硬化症(ALS)は、運動ニューロンの進行性変性を特徴とする。多様なALSの動物モデルの星状膠細胞(Astrocyte)は、神経細胞との共培養で運動ニューロンの細胞死を誘導する。 NAD +の利用性を高める、またはNAD +依存型脱アセチル化酵素のSIRT3とSIRT6の発現を増やすと、細胞培養モデルでの神経毒性が阻止される。
マウスのALSモデルでNAD +の利用性を高める効果を評価するために、NAD +を消費する酵素(CD38)の阻害と生体利用可能なNAD +前駆体(ニコチンアミドリボシド)の補給という2つの戦略を使用した。
CD38の活性阻害は、hSOD1にリンクした2種類のALSマウスモデルの生存に影響を与えなかった。
一方、ニコチンアミド・リボシドの補充は運動ニューロンの変性を遅らせ、脊髄の神経炎症のマーカーを減少させ、筋肉の代謝を変化させ、hSOD1マウスの生存を適度に増加させた。 さらに、ALS患者における脊髄におけるNAD +合成に関与する酵素(NAMPTおよびNMNAT2)の発現の変化と、SIRT6発現の低下を確認した。
これは、人間のALSの病理において、NAD +に関連した神経保護経路の欠損を示唆している。 私たちのデータは、ALSにおけるNAD +レベルの増加による治療の可能性を示唆している。
さらに、NAD +レベルを高める治療がALSの動物モデルの病状改善に有効であり、生体利用可能なNAD +の前駆体を使用してNAD +レベルを高めることがALSの治療法として有望であることを示唆している。ニコチンアミド・リボシドをサプリメントとして補充すると体内のNAD +レベルを高めることができます。つまり、ALSの治療にニコチンアミド・リボシドの補充療法が有効である可能性を示唆しています。
図:ニコチンアミド・アデニン・ジヌクレオチド(nicotinamide adenine dinucleotide:NAD +)はトリプトファンやニコチン酸やニコチンアミドなどから生成するルートもあるが、特にNAD +の前駆物質であるニコチンアミド・モノヌクレオチド(nicotinamide mononucleotide:NMN)とニコチンアミド・リボシド(nicotinamideriboside:NR)をサプリメントとして摂取すると体内のNAD +を増やすことができる。
【ジクロロ酢酸ナトリウムはミトコンドリア機能を活性化する】
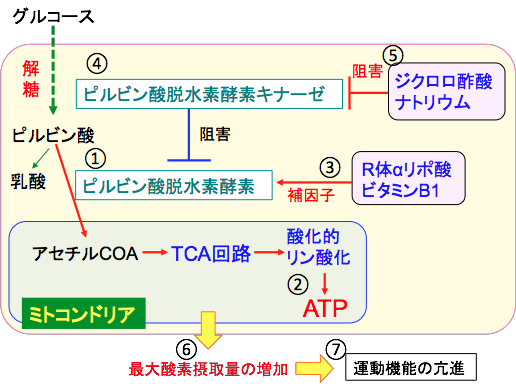
ジクロロ酢酸ナトリウム(Sodium Dichloroacetate)はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素を活性化します。ピルビン酸脱水素酵素はピルビン酸をアセチルCoAに変換する酵素で、ミトコンドリアでのTCA回路での代謝を亢進します。
ジクロロ酢酸ナトリウムはミトコンドリアでのグルコース代謝とATP産生を亢進します。 ALSの動物実験モデルでジクロロ酢酸ナトリウムは脊髄の運動ニューロンの減少を25%抑制し、ALSの運動機能障害の発症を遅らせ、生存期間を延ばす効果が報告されています。
医薬品のジクロロ酢酸ジイソプロピルアミン製剤のリバオールもミトコンドリアの活性を高めます。 ジクロロ酢酸ナトリウムやジクロロ酢酸ジイソプロピルアミンを摂取するときはビタミンB1を多めに摂取します。 健康飲料のリゲインにはジクロロ酢酸ジイソプロピルアミンとビタミンB1が入っています。体力や運動能力を高める効能を宣伝している健康飲料の多くにジクロロ酢酸ジイソプロピルアミンとビタミンB1が添加されてます。
以下のような報告があります。
【要旨】
ミトコンドリア機能障害は、筋萎縮性側索硬化症(ALS)の神経変性につながる病原性メカニズムの1つである。 ALS発症に関連するSOD1(G93A)変異を発現する星状膠細胞はミトコンドリアの呼吸能力の低下を示し、運動ニューロンの死を引き起こす原因と関連する。
星状膠細胞を介した毒性は、ミトコンドリアを標的とした抗酸化剤によって防ぐことができ、神経毒性の発現におけるミトコンドリアの重要な役割を示している。 しかし、ミトコンドリアの代謝を活性化するために現在使用されている薬物がALSの進行を抑制できるかどうかは不明である。
ここでは、ピルビン酸脱水素酵素複合体活性(PDH)の活性化によりミトコンドリアの機能状態を改善するジクロロ酢酸(DCA)の疾患修飾効果をテストした。
SOD1(G93A)変異を発現するラットから分離された星状膠細胞培養にジクロロ酢酸を投与すると、ジクロロ酢酸はピルビン酸脱水素酵素複合体のリン酸化を低減し、ミトコンドリアにおける酸素呼吸を亢進した。 特に、ジクロロ酢酸はSOD1(G93A)アストロサイトの共培養条件での運動ニューロンへの毒性を完全に防止した。
SOD1(G93A)変異を発現しているマウスの飲料水中にジクロロ酢酸(500 mg / L)を慢性投与すると、未投与のマウスと比較して生存が2週間増加した。 全身性のジクロロ酢酸の投与は、SOD1(G93A)変異マウスの腰髄組織で測定された減少したミトコンドリア呼吸を正常化した。
ジクロロ酢酸の顕著な効果は、疾患の末期における握力のパフォーマンスの改善であり、これは、長指伸筋の神経筋接合部領域の回復と相関していた。全身性のジクロロ酢酸の投与は、SOD1(G93A)マウスにおいてアストロサイトの反応性を減少させ、運動ニューロンの損失を防いだ。
以上の結果から、ジクロロ酢酸によるミトコンドリアの酸化還元状態の改善が、ALSの治療に役立つ可能性を示している。ジクロロ酢酸ナトリウムとビタミンB1とR体αリポ酸の組合せは、ミトコンドリアを活性化する機序でALSの進行を抑制します。
図:グルコースが解糖系で代謝されてピルビン酸に変換された後、ピルビン酸脱水素酵素によってミトコンドリア内でアセチルCoAに変換される(①)。アセチルCoAはミトコンドリア内でTCA回路と呼吸酵素複合体における酸化的リン酸化によってATPが産生される(②)。R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の活性に必要な補因子(③)。ピルビン酸脱水素酵素はピルビン酸脱水素酵素キナーゼによってリン酸化されることによって活性が阻害されている(④)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する作用があり、その結果ピルビン酸脱水素酵素を活性化する(⑤)。これらの組合せは、筋肉と心臓のエネルギー産生を高めることができ、最大酸素摂取量が増加し(⑥)、持久力など運動のパフォーマンスを高めることができる(⑦)。
ニコチンアミド・リボシドとジクロロ酢酸ナトリウムを用いた筋萎縮性側索硬化症の治療:
ニコチンアミド・リボシド:20,000円 / 50g(消費税込み)
ジクロロ酢酸ナトリウム:12,000円 / 30g(消費税込み)
ALSの治療には、1日にニコチンアミド・リボシドを1000mgから2000mg、ジクロロ酢酸ナトリウムは1日に体重1kg当たり10mgから15mgを服用します。
ビタミンB1を1日100mgから200mg程度摂取します。
R体αリポ酸を併用するとさらに有効です。さらに、ミトコンドリアを活性化するサプリメントや抗酸化作用のあるサプリメントを併用するとALSに対する治療効果が高まります。
図:ニコチンアミド・アデニン・ジヌクレオチド(NAD+)の前駆体のニコチンアミド・リボシドの補充はNAD+/NADH比を高め(①)、サーチュイン1を活性化する(②)。サーチュイン1はPGC-1α(PPARγコアクチベーター1α)を活性化し(③)、PGC-1αはミトコンドリア新生を亢進して(④)、細胞内のミトコンドリアの数と量を増やす(⑤)。PPAR(ペルオキシソーム増殖因子活性化受容体)の汎アゴニスト(受容体に結合して活性化する物質)であるベザフィブラートは、直接あるいはPPARを介してPGC-1αを活性化する(⑥)。ジクロロ酢酸とビタミンB1はピルビン酸脱水素酵素を活性化する機序でミトコンドリア機能(物質代謝とエネルギー産生)を亢進する(⑦)。ミトコンドリアは活性酸素種によってダメージを受けている(⑧)。抗酸化作用のあるCoQ10、αリポ酸は酸化ストレスを軽減して、ミトコンドリアのダメージを阻止する(⑨)。したがって、ニコチンアミド・リボシド+ジクロロ酢酸+ビタミンB1+ベザフィブラート+CoQ10+αリポ酸の組合せは、老化に伴う諸臓器機能の低下の改善や、ミトコンドリアの機能低下による様々な疾患(筋萎縮性側索硬化症など)の治療に試してみる価値がある。
筋萎縮性側索硬化症の治療に関するご質問やサプリメントのご購入に関してはメール(info@f-gtc.or.jp)か電話(03-5550-3552)かファックス(03-3541-7577)でお問合せ下さい。